Известно, что здоровый сон играет огромную роль в поддержании физического здоровья человека, регуляции метаболических процессов, сохранении психических и когнитивных функций. Накоплено достаточно большое количество научных данных о влиянии сомнологических проблем на синтез гормонов, а также обратном влиянии некоторых гормонов на сон и его качество, в том числе при различных нозологиях. В статье рассматривается связь синдрома обструктивного апноэ сна (СОАС) и андрогенодефицита, особенности клинического течения, диагностики и лечения.

Синдром обструктивного апноэ сна. Определение и распространенность
СОАС занимает одно из ведущих мест в структуре всех нарушений сна. Это патологическое состояние, характеризующееся наличием храпа, периодическим спадением верхних дыхательных путей на уровне глотки и прекращением легочной вентиляции при сохранении дыхательных усилий, что приводит к снижению насыщения крови кислородом, грубой фрагментации сна и избыточной дневной сонливости. По Международной классификации болезней 10 пересмотра данная патология кодируется как G47.3 Апноэ во сне: центральное, обструктивное.
Истинная распространенность СОАС в мире точно не установлена. По данным крупных эпидемиологических исследований, более 900 миллионов человек в возрасте 30–69 лет могут иметь СОАС, из них около 500 миллионов — СОАС умеренной и тяжелой степени. Подавляющее большинство пациентов не знают о своем диагнозе.
По данным российских исследований, СОАС у мужчин встречается примерно в 3 раза чаще, чем у женщин, что объясняется анатомическими особенностями дыхательных путей и гормональным фоном. Самая высокая распространенность приходится на возраст 40–60 лет и достигает 33% среди мужчин, а среди мужчин старше 65 лет показатели могут быть еще выше — до 84% для легкой формы и 36% для умеренной и тяжелой форм.
Симптомы СОАС условно можно разделить на две группы: проявляющиеся в период бодрствования и отмеченные во время сна.
Основными жалобами в период бодрствования являются неосвежающий сон, дневная сонливость, слабость и утомляемость, повышение АД после пробуждения, головные боли в утреннее время, когнитивный дефицит (ухудшение памяти и снижение концентрации внимания), снижение либидо и эректильная дисфункция. В ночное время отмечается громкий храп с остановками дыхания, ощущения удушья, которые могут приводить к пробуждению; беспокойный сон, ночная потливость и никтурия.
При обследовании мужчин следует обратить внимание на следующие факторы риска:
- Избыточная масса тела или ожирение
- Окружность шеи более 43 см
- Возраст старше 50 лет
- Этническая принадлежность (азиатское население, афроамериканцы)
- Курение и употребление алкоголя
- Особенности челюстно-лицевого анатомического строения (микрогнатия, ретрогнатия, длинный небный язычок и увеличенное мягкое небо, увеличенные миндалины и аденоиды, толстые боковые стенки глотки и парафарингеальные жировые отложения)
- Выраженная дневная сонливость
Андрогенодефицит у мужчин
Андрогенодефицит (гипогонадизм) — это клинический и биохимический синдром, связанный с низким уровнем тестостерона, а также нечувствительностью рецепторного аппарата к нему и его метаболитам, который может оказывать негативное воздействие на множество органов и систем, ухудшая качество жизни и прогноз. Диагноз устанавливается на основании клинических симптомов и стойкого снижения уровня тестостерона, подтвержденного как минимум двукратным лабораторным определением.
Андрогенодефицит встречается у 5% мужчин без сопутствующей хронической патологии, но в случае наличия у мужчины сопутствующих хронических заболеваний распространенность его может достигать 30%.
Основными симптомами дефицита тестостерона являются снижение либидо и эректильной функции, уменьшение мышечной массы и силы мышц, висцеральное ожирение, метаболический синдром, мужское бесплодие, гинекомастия, изменения настроения, повышенная утомляемость и раздражительность, приливы, снижение когнитивных способностей, снижение минеральной плотности костей с развитием остеопороза и риском низкотравматичных переломов. Достаточно много симптомов перекликаются с клиническими проявлениями СОАС, но и само по себе нарушения сна часто является симптомом андрогенодефицита.
Пороговым значением общего тестостерона у всех мужчин, принятым для диагностики андрогенодефицитного состояния, рекомендуется считать 12,1 нмоль/л. При уровне общего тестостерона от 8 до 12 нмоль/л рекомендуется определить уровень глобулина, связывающего половые гормоны (ГСПГ), с дальнейшим расчетом уровня свободного тестостерона, нижняя граница нормы которого составляет 243 пмоль/л.
Взаимосвязь СОАС и андрогенодефицита у мужчин
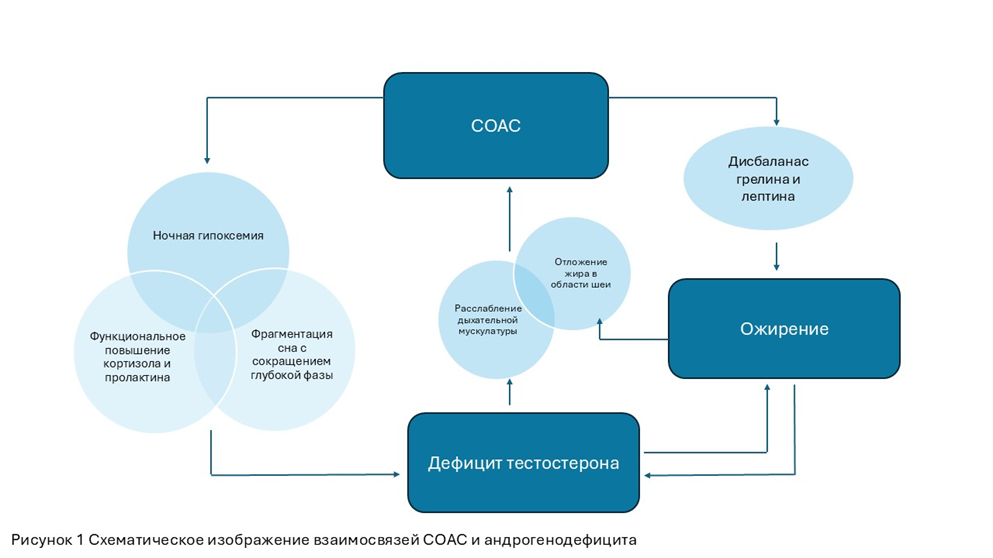
Метаанализ большого количества исследований (PubMed, Web of Science, Cochrane Library, EMBASE) показал достоверную корреляцию андрогенодефицита с наличием СОАС. Решающее значение в развитии андрогенодефицита при СОАС классически отводится ожирению, но не меньшую роль в снижении тестостерона имеет комплексный эффект гипоксии, частых ночных пробуждений и нарушение архитектуры сна с его грубой фрагментацией.
Известно, что максимальная выработка гонадолиберинов, лютеинизирующего гормона (ЛГ) и тестостерона у мужчин происходит преимущественно в фазу медленного (глубокого) сна, что обеспечивает синхронность гормональной регуляции. Именно в эту фазу начинает активно вырабатываться тестостерон, и чем продолжительнее и качественнее эта фаза, тем выше его уровень к утру (пик концентрации достигается к 5-6 часам утра). Нарушение архитектуры сна с сокращением фазы глубокого сна обуславливает нарушение выработки тестостерона и 17-ОН-прогестерона, несмотря на сохранение общей продолжительности сна.
Кроме того гипоксемия, возникающая во время сна у мужчин с СОАС, стимулирует симпатическую нервную систему и приводит к транзиторному функциональному гиперкортицизму. Повышенный кортизол подавляет функцию гипофизарно-гонадной оси, способствуя развитию функциональной гиперпролактинемии и снижая выработку ЛГ. Это усугубляется ростом пролактина за счет фрагментации сна и смещения пиков его секреции. Повышение секреции пролактина дополнительно тормозит синтез гонадолиберина в гипоталамусе и угнетает гонадотропную функцию гипофиза, усугубляя дефицит тестостерона.
Сокращение времени сна, а также его фрагментация, снижают уровень лептина, который в норме достигает максимальных концентраций в фазе глубокого сна, способствуя подавлению аппетита ночью. В то же время при этом происходит стимуляция выработки грелина, который в избытке приводит к усилению чувства голода и перееданию. Дисбаланс синтеза лептина и грелина усугубляет прогрессивное нарастание массы тела у пациента.
От концентрации тестостерона зависит тонус и масса мышц, в том числе мышц глотки и дыхательных путей. Снижение тонуса мышц, расслабление и коллапс дыхательной мускулатуры во время сна при дефиците тестостерона усугубляет обструкцию дыхательных путей и увеличивает частоту апноэ.
Дефицит тестостерона способствует накоплению жира, при этом отложение жира в области шеи приводит к сужению просвета глотки и ухудшает течение СОАС.
Таким образом, патофизиологические изменения при СОАС (грубая фрагментация сна, ночная гипоксемия, гормональная дизрегуляция и метаболические нарушения) приводят к андрогенодефициту у мужчин, а это в свою очередь усугубляет апноэ. Схематическое изображение взаимосвязи СОАС и андрогенодефицита представлены на рисунке 1. Это создает порочный круг, усиливая клинические проявления СОАС и ухудшая качество жизни пациентов. При этом характерная клиника СОАС тесно перекликается с симптомами андрогенодефицита и влечет за собой различные последствия и риски для здоровья мужчины.
Последствия для мужчин
Существующие данные показали ассоциацию высокого риска эректильной дисфункции и СОАС. Использование опросника Международного индекса эректильной функции (International Index of Erectile Function, IIEF-15) у пациентов с подозрением на СОАС и дальнейшим проведением им полисомнографии показало наличие эректильной дисфункции у мужчин с СОАС в 69% случаев, а без СОАС — в 34% случаев. При этом средний уровень насыщения кислородом ночью был независимым фактором риска эректильной дисфункции и снижения либидо. В другом исследовании распространенность эректильной дисфункции у пациентов с умеренным и тяжёлым СОАС составила 51%.
Метаболические расстройства у мужчин с андрогенодефицитом и СОАС имеют сложную взаимосвязь и усугубляют течение друг друга. Дефицит тестостерона тесно ассоциирован с инсулинорезистентностью и ухудшением течения сахарного диабета 2 типа, что отражено в клинических рекомендациях по ожирению и алгоритмах специализированной медицинской помощи больным сахарным диабетом. Мужчинам с ожирением и симптомами дефицита тестостерона, а также всем пациентам с ожирением и сахарным диабетом 2 типа вне зависимости от наличия симптомов, ассоциированных с дефицитом тестостерона, рекомендовано ежегодное обследование с целью выявления гипогонадизма, который может усугублять метаболические нарушения и снижать качество жизни.
В гайдлайнах Американской Ассоциации клинических эндокринологов (AACE) и Европейской Ассоциации по изучению диабета (EASD), рекомендациях по диагностике, лечению и мониторингу гипогонадизма у мужчин ISSAM делается акцент на значимости оценки андрогенного статуса у мужчин с метаболическим синдромом, ожирением и сахарным диабетом 2 типа, так как андрогенодефицит ассоциирован с ухудшением метаболического контроля и повышенным риском сердечно-сосудистых заболеваний.
Анализ базы данных PubMed показал, что у пациентов с СОАС хуже показатели внимания, памяти и исполнительных функций, чем у здоровых лиц. Выраженность когнитивных нарушений коррелируют с тяжестью СОАС. Анализ данных полисомнографии и нейропсихологической оценки в течение 5 лет наблюдения выявили ассоциацию между тяжестью СОАС и ухудшением когнитивных функций, увеличением риска деменции. Когнитивные нарушения обусловлены повреждением нейронов, снижением объёма серого вещества головного мозга в условиях хронической ночной гипоксемии. При этом дефицит тестостерона, который в норме оказывает нейропротективный эффект, усугубляет течение заболевания.
Высоко распространены у пациентов с СОАС и сердечно-сосудистые заболевания. СОАС выявляется у 30-50% пациентов с артериальной гипертензией и до 85% у пациентов с рефрактерным течением артериальной гипертензии. СОАС, андрогенодефицит и артериальная гипертензия имеют общие факторы риска, такие как ожирение и возраст. Безусловно, развитию артериальной гипертензии способствует гипоксемия во время ночных эпизодов апноэ/гипопноэ, гиперактивация симпатической нервной системы, системная вазоконстрикция, окислительный стресс и системное воспаление.
СОАС часто сопровождается различными нарушениями сердечного ритма, а также может являться их самостоятельной причиной. Риск возникновения аритмий, ассоциированных с апноэ, прогрессивно нарастает с тяжестью СОАС и развивающейся гипоксемии. СОАС повышает риск развития фибрилляции предсердий, особенно у лиц моложе 65 лет. Дополнительно повышается риск сердечно-сосудистой смерти, в том числе внезапной.
Выявлена значимая корреляция между уровнем тестостерона и маркерами атеросклероза. Низкий уровень тестостерона у мужчин ассоциируется с дисфункцией эндотелия и толщиной комплекса интима–медиа сонных артерий независимо от других факторов сердечно-сосудистого риска. Все больше исследований подтверждают связь между низким уровнем тестостерона и системным низкоуровневым воспалением.
Имеются убедительные данные наблюдений, указывающие на то, что низкий уровень тестостерона связан с повышенным риском смерти от всех причин и сердечно-сосудистых заболеваний.
Диагностика и лечение
Понимая тесные взаимосвязи развития СОАС и андрогенного дефицита у мужчин, важно диагностировать обе эти проблемы и выбрать оптимальную стратегию коррекции.
Для скрининга СОАС в условиях амбулаторно-поликлинического приема могут быть использованы различные шкалы и опросники: опросник STOP-BANG, модифицированный опросник Страдлинга, опросник сонливости Эпфорта, Берлинский опросник.
«Золотым стандартом» диагностики СОАС является полисомнография с видеоконтролем, но в повсеместной клинической практике его использование ограничено в связи с дороговизной, сложностью и низкой доступностью для пациентов. В большинстве случаев для диагностики применяются такие методы, как компьютерная сомнография, респираторное мониторирование, кардиореспираторный мониторинг.
Диагностика андрогенодефицита базируется на оценке клинических симптомов, в том числе с помощью опросников Aging Male Symptoms (AMS), Androgen Deficiency in Aging Male (ADAM), Massachusetts Male Aging Study (MMAS), и двукратном лабораторном подтверждении сниженного уровня тестостерона в крови.
Основные стратегии лечения СОАС и андрогенодефицита:
- Снижение массы тела
- СИПАП-терапия
- Заместительная терапия тестостероном
«Золотым стандартом» лечения СОАС умеренной и тяжелой степени является СИПАП-терапия.
СИПАП (от англ. CPAP — Continuous Positive Airway Pressure) – аппаратный метод создания постоянного положительного давления в дыхательных путях с целью преодоления сил мягких тканей, стремящихся сжать верхние дыхательные пути, тем самым открывая дыхательные пути. Кроме того, СИПАП увеличивает объем легких в конце выдоха, стабилизируя верхние дыхательные пути, что приводит к предотвращению спадения верхних дыхательных путей.
В настоящее время разработаны различные варианты аппаратов с возможностью расширения функциональных возможностей СИПАП:
- Auto-СИПАП — аппарат с автоматической регулировкой положительного давления в дыхательных путях, обеспечивает возможность изменения уровня положительного давления в дыхательных путях в зависимости от изменений воздушного потока.
- БИПАП (BiPAP, Biphasic Positive Airway Pressure) — отличается подачей воздуха в верхние дыхательные пути под двумя уровнями положительного давления: более высоким на вдохе (IPAP) и более низким на выдохе (EPAP). Такой режим облегчает дыхание, снижая нагрузку на дыхательную мускулатуру и улучшая насыщение крови кислородом при тяжелых формах СОАС и сопутствующих заболеваниях
- ТРИПАП (TriLevel Positive Airway Pressure) — позволяет обеспечивать три уровня давления воздуха во время дыхания пациента: на вдохе (IPAP), на выдохе (EPAP) и на конечной фазе выдоха (EEPAP).
- Адаптивная серво-вентиляция (АСВ) – аппаратный метод лечения сложных нарушений дыхания во сне, в частности, сочетания СОАС с центральным апноэ сна посредством плавного изменения разницы между давлением на вдохе и на выдохе в зависимости от дыхательного потока в каждом дыхательном цикле, тем самым, выравнивая дыхание пациента.
СИПАП-терапия приводит к значительному снижению индекса апноэ-гипопноэ, улучшению сатурации кислорода в ночное время, уменьшению фрагментации и нормализации архитектуры сна, что приводит к уменьшению субъективной и объективной дневной сонливости, снижению системного артериального давления, а также улучшению качества жизни.
Приемлемым считается соблюдение режима лечения в течение ≥4,5 часов в сутки, но, в идеале, соблюдение режима СИПАП-терапии должно сохраняться на протяжении всего времени, когда пациент спит. В исследованиях подтверждается дозозависимый эффект, который объясняет реализацию различных вариантов клинического улучшения в зависимости от времени использования аппарата. Использование СИПАП более 5 часов за ночь уже приводит к снижению артериального давления у пациентов с СОАС и рефрактерным течением артериальной гипертензии и ассоциировано со снижением частоты сердечно-сосудистых событий. Использование аппарата в течение более 6 часов снижает сонливость, улучшает повседневное функционирование и когнитивные функции.
Критерии приемлемости СИПАП:
- Минимум 70% ночей
- Минимум 4,5 часа за ночь
Это позволяет добиваться клинической эффективности СИПАП-терапии.
Улучшению течения СОАС способствуют комплексные мероприятия по снижению массы тела. Снижение массы тела на 10% ассоциировано с уменьшением индекса апноэ-гипопноэ на 26% и может быть эффективной стратегией лечения СОАС при ИМТ до 35 кг/м2. У пациентов с морбидным ожирением снижение массы тела после проведения бариатрических операций приводит к снижению индекса апноэ-гипопноэ в среднем на 50–70%, при этом полная ремиссия СОАС наблюдается у 65% пациентов.
Сложности снижения массы тела у пациентов с ожирением и СОАС без использования СИПАП-терапии связаны с различными механизмами: низкий уровень активности и мотивации пациентов к ее увеличению за счет постоянной усталости и дневной сонливости, повышенный уровень тревожно-депрессивных расстройств у данной когорты пациентов и эмоциогенный тип пищевого поведения. Показано, что до 81,2% пациентов не достигают клинически значимого снижения массы тела на фоне комплексного лечения ожирения без применения СИПАП-терапии. Применение СИПАП у больных со средней и тяжелой степенью СОАС приводит к более выраженному снижению массы тела на фоне комплексных мероприятий по снижению массы тела.
Как перспективное направление в лечении СОАС в настоящее время рассматриваются препараты для лечения ожирения из группы арГПП-1 (агонисты рецепторов глюкагоноподобного пептида-1, например, лираглутид и семаглутид) и двойные агонисты рецепторов глюкагоноподобного пептида-1 и глюкозозависимого инсулинотропного полипептида (тирзепатид). СОАС обозначен в качестве показания к назначению этих препаратов пациентам с ИМТ 27,0 кг/м2 и более.
Сохранение СОАС после снижение массы тела в ряде случаев связано с наличием анатомических особенностей челюстно-лицевого аппарата (например, ретрогнатия, микрогнатия, гипертрофия миндалин, аденоиды), в таких случаях решается вопрос о возможности хирургической коррекции (sleep surgery).
Снижение массы тела, в том числе с помощью модификации питания и образа жизни, медикаментозной терапии или бариатрической хирургии, способствует повышению уровня тестостерона и улучшению чувствительности к инсулину. В исследованиях показано восстановление уровня тестостерона после бариатрической операции, при этом у большинства мужчин уровень тестостерона нормализуется в течение 2–5 лет после снижения веса (конечно, при этом нужно учитывать возраст пациента).
В то же время изолированное применение СИПАП по данным нескольких метаанализов не приводит к значимому повышению уровня тестостерона у мужчин с СОАС, хотя улучшает эректильную функцию. Для коррекции андрогенного дефицита необходимо рассмотреть вопрос сочетания СИПАП-терапии и заместительной терапии тестостероном. Исследования показывают более высокую эффективность комбинированного лечения.
Данные о заместительной терапии тестостероном у пациентов с СОАС ограничены и противоречивы. С одной стороны, восполнение дефицита тестостерона способствует улучшению качества жизни, снижению симптомов эректильной и сексуальной дисфункции, нормализации показателей углеводного обмена. С другой стороны, заместительная терапия тестостероном в некоторых ситуациях может способствовать ухудшению течения СОАС. Тестостерон снижает чувствительность дыхательного центра к уровню углекислого газа, что может провоцировать появление центральных апноэ сна и удлинять эпизоды обструктивных апноэ, особенно у пациентов с тяжелым и нелеченным СОАС. Тестостерон способствует задержке жидкости и росту мышечной массы, что может косвенно увеличивать объем тканей в области шеи и глотки, сужая дыхательные пути и тем самым усугубляя обструкцию и течение СОАС. В то же время отмечено положительное влияние тестостерона на мышечную силу, что может и улучшить дыхательную функцию, снижая риск спадения дыхательных путей.
Кроме того, важно учитывать, что при СОАС компенсаторно может развиться вторичная полицитемия, а заместительная терапия тестостероном может усугубить ее. Терапия тестостероном противопоказана при гематокрите более 54%, что обязательно нужно учитывать у пациентов с СОАС, а выявление полицитемии у пациента с андрогенодефицитом требует дообследования для исключения СОАС до начала приема препарата.
Для лечения андрогенного дефицита у пациента с СОАС следует отдать предпочтение трансдермальным формам короткого действия перед инъекционными формами длительного действия с целью обеспечения безопасности лечения, так как супрафизиологические концентрации тестостерона, возникающие при лечении инъекционными препаратами в большей степени могут ухудшить течение СОАС, тогда как долгосрочное применении более низких доз при трансдермальном введении в конечном итоге могут привести к клиническому улучшению симптомов апноэ.
Заключение
СОАС и андрогенодефицит – сложная клиническая проблема с перекликающимися патофизиологическими механизмами, требующая комплексного подхода как в диагностике, так и в выборе оптимальной стратегии лечения. Здесь нет единственно верного решения, в каждой конкретной ситуации вопрос решается индивидуально: в зависимости от степени СОАС, выраженности ожирения, метаболических проблем, наличия сопутствующих заболевания, клинических проявлений андрогенодефицита, приемлемости терапии. И важно не только взаимное отягощающее влияние СОАС и андрогенодефицита друг на друга, но и возможность получения максимальной эффективности при оптимальном использовании комбинированного подхода к лечению пациента.
Список литературы
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом / под ред. И.И. Дедова, М.В. Шестаковой, О.Ю. Сухаревой. — 12-й вып. — М., 2025.
- Дедов И.И., Мокрышева Н.Г., Мельниченко Г.А. и др. Проект клинических рекомендаций «Синдром гипогонадизма у мужчин» // Ожирение и метаболизм. — 2021. — Т. 18, № 4. — С. 496–507. — DOI: 10.14341/omet12817.
- Клинические рекомендации. Ожирение / Российская ассоциация эндокринологов, Общество бариатрических хирургов. — 2024. — URL: https://cr.minzdrav.gov.ru/preview-cr/28_3.
- Литвин А.Ю., Чазова И.Е., Елфимова Е.М. и др. Клинические рекомендации Евразийской Ассоциации Кардиологов и Российского общества сомнологов по диагностике и лечению обструктивного апноэ сна у пациентов с сердечно-сосудистыми заболеваниями // Евразийский кардиологический журнал. — 2024. — № 3. — С. 6–27. — DOI: 10.38109/2225-1685-2024-3-6-27.
- Мадаева И.М., Бердина О.Н., Семенова Н.В. и др. Синдром обструктивного апноэ сна и возрастной гипогонадизм // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуск. — 2017. — Т. 117, № 42. — С. 79–83.
- Мадаева И.М., Бердина О.Н., Шолохов Л.Ф. и др. Патофизиологические аспекты функционирования системы нейроэндокринной регуляции при синдроме обструктивного апноэ сна // Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуск. — 2018. — Т. 118, № 42. — С. 55–59.
- Синдром обструктивного апноэ сна и нарушения сердечного ритма // Эффективная фармакотерапия. Неврология. Спецвып. «Сон и его расстройства – 3». — № 53.
- Струева Н.В. и др. Эффективность лечения ожирения у больных с инсомнией и синдромом обструктивного апноэ сна // Ожирение и метаболизм. — 2015. — Т. 13, № 2. — С. 25–32. — DOI: 10.14341/omet2016225-32.
- Хабибулина М. Церебральная гемодинамика при артериальной гипертензии и андрогенодефиците // Врач. — 2018. — № 4. — URL: https://cyberleninka.ru/article/n/tserebralnaya-gemodinamika-pri-arterialnoy-gipertenzii-i-androgenodefitsite (дата обращения: 14.06.2025).
- Хрипун И.А., Беляева Е.В. Нарушения сна и дефицит тестостерона у мужчин // Вестник урологии. — 2024. — Т. 12, № 6. — С. 52–58. — DOI: 10.21886/2308-6424-2024-12-6-52-58.
- Budweiser S., Enderlein S., Jörres R.A. et al. Sleep apnea is an independent correlate of erectile and sexual dysfunction // J Sex Med. — 2009. — Vol. 6, No. 11. — P. 3147–3157. — DOI: 10.1111/j.1743-6109.2009.01372.x.
- Caporale M., Palmeri R., Corallo F. et al. Cognitive impairment in obstructive sleep apnea syndrome: a descriptive review // Sleep Breath. — 2021. — Vol. 25, No. 1. — P. 29–40. — DOI: 10.1007/s11325-020-02084-3.
- Copinschi G. Metabolic and endocrine effects of sleep deprivation // Essent Psychopharmacol. — 2005. — Vol. 6, No. 6. — P. 341–347.
- Graziani A., Grande G., Ferlin A. The complex relation between obstructive sleep apnoea syndrome, hypogonadism and testosterone replacement therapy // Front Reprod Health. — 2023. — Vol. 5. — Article 1219239. — DOI: 10.3389/frph.2023.1219239.
- Kellesarian S.V., Malignaggi V.R., Feng C. et al. Association between obstructive sleep apnea and erectile dysfunction: a systematic review and meta-analysis // Int J Impot Res. — 2018. — Vol. 30, No. 3. — P. 129–140. — DOI: 10.1038/s41443-018-0017-7.
- Liu L., Kang R., Zhao S. et al. Sexual Dysfunction in Patients with Obstructive Sleep Apnea: A Systematic Review and Meta-Analysis // J Sex Med. — 2015. — Vol. 12, No. 10. — P. 1992–2003. — DOI: 10.1111/jsm.12983.
- Lundy S.D., Parekh N.V., Shoskes D.A. Obstructive Sleep Apnea Is Associated With Polycythemia in Hypogonadal Men on Testosterone Replacement Therapy // J Sex Med. — 2020. — Vol. 17, No. 7. — P. 1297–1303. — DOI: 10.1016/j.jsxm.2020.03.006.
- Pascual M., de Batlle J., Barbé F. et al. Erectile dysfunction in obstructive sleep apnea patients: A randomized trial on the effects of CPAP // PLoS One. — 2018. — Vol. 13, No. 8. — Article e0201930. — DOI: 10.1371/journal.pone.0201930.
- Pase M.P., Harrison S., Misialek J.R. et al. Sleep Architecture, Obstructive Sleep Apnea, and Cognitive Function in Adults // JAMA Netw Open. — 2023. — Vol. 6, No. 7. — Article e2325152. — DOI: 10.1001/jamanetworkopen.2023.25152.
- Schmid S.M., Hallschmid M., Jauch-Chara K. et al. A single night of sleep deprivation increases ghrelin levels and feelings of hunger in normal-weight healthy men // J Sleep Res. — 2008. — Vol. 17, No. 3. — P. 331–334. — DOI: 10.1111/j.1365-2869.2008.00662.x.
- Wang H., Lu J., Xu L. et al. Obstructive sleep apnea and serum total testosterone: a system review and meta-analysis // Sleep Breath. — 2023. — Vol. 27, No. 3. — P. 789–797. — DOI: 10.1007/s11325-022-02655-6.